Dung dịch nước muối là dung dịch có thể dẫn điện và được gọi là chất điện li. Vậy chất điện li là gì? Chúng được phân loại và đặc trưng như thế nào? Hôm nay, hãy cùng chúng tôi khám phá thông tin này qua bài viết dưới đây:
Chất điện li là gì?
Chất điện li còn được gọi là chất điện giải, chất điện giải hay tiếng Anh là electrolyte. Đây là những chất tan trong nước và phân ly tạo thành ion âm hoặc dương. Một số chất bạn thường gặp bao gồm: axit, bazơ và muối.

Quá trình phân ly các chất điện giải trong nước (hoặc khi tan chảy) để tạo ra các ion được gọi là điện phân.

Cơ chế điện phân các hợp chất: Khi cho một hợp chất vào dung dịch nước. Lúc này sẽ có sự tương tác giữa các phân tử nước và phân tử hợp chất.
Trong đó: Các phân tử tích điện âm của Chất điện li sẽ kết hợp với các phân tử tích điện dương của dung dịch nước và ngược lại.

Quá trình tương tác này cùng với sự chuyển động không ngừng của các phân tử nước sẽ tạo ra quá trình điện phân các phân tử Chất điện li thành các ion tích điện dương và âm trong dung dịch nước.
Các hợp chất như glycerol, rượu ethyl, v.v. không được coi là chất điện ly vì phân tử của chúng tuy có liên kết phân cực nhưng rất yếu nên dưới tác dụng của phân tử nước chúng không thể tách rời được. Li tạo ra các ion.
Thuyết điện li
Trong dung dịch hòa tan, các hợp chất hóa học như bazơ, axit và muối bị phân hủy (một phần hoặc hoàn toàn) thành các nguyên tử tích điện (hoặc nhóm nguyên tử) gọi là ion. Các ion này có thể di chuyển tự do trong dung dịch và trở thành hạt mang điện.
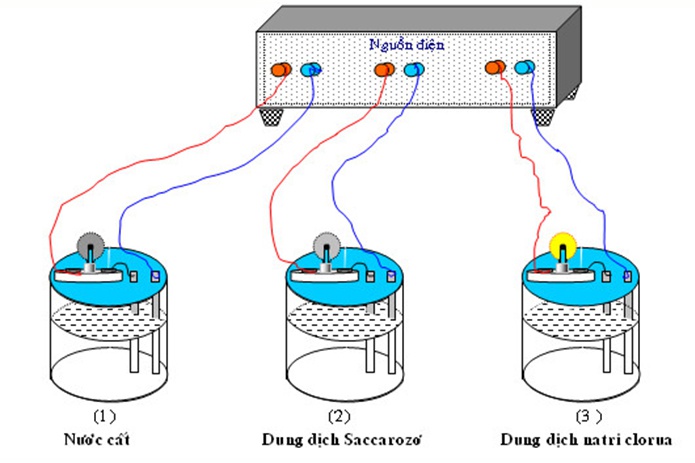
Ion có hai loại:
- Cation: là các ion mang điện tích dương của nguyên tố. Đây là các ion kim loại, ion H+ hoặc một nhóm nguyên tử khác.
- Anion: là các ion tích điện âm của một nguyên tố, thường là gốc axit hoặc nhóm (OH).

Sự phân ly của một số chất tạo ra các ion:
- Axit sau khi phân ly sẽ tạo ra: gốc axit (ion âm) và H+
- Sau khi phân ly, các bazơ sẽ tạo ra: OH– (ion âm) + ion dương (kim loại)
- Khi muối phân ly tạo thành: gốc axit (ion âm) + ion dương (kim loại)
- Một số bazơ không chứa ion kim loại mà còn phân ly tạo thành ion trong dung dịch
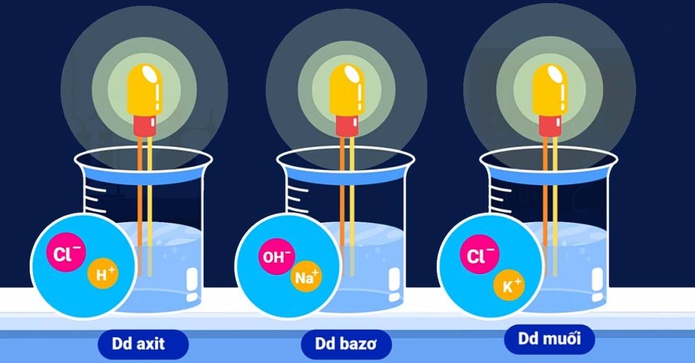
Phân loại chất điện li
Chúng được chia làm 2 loại chính: chất điện ly mạnh và chất điện ly yếu, chúng ta cùng tìm hiểu chi tiết dưới đây nhé:
Dạng yếu
Là chất khi hòa tan trong dung dịch nước chỉ có một số phân tử hòa tan phân ly tạo thành ion, số còn lại vẫn tồn tại dưới dạng phân tử của chất đó trong dung dịch. Các chất yếu bao gồm: axit yếu (H2S, H2CO3, H3PO4,…), bazơ yếu không tan (Mg(OH)2, Fe(OH)2, Fe(OH)3,…)
Chúng được đánh giá bằng lượng chất điện ly α và được tính theo công thức: α = số phân tử phân ly/tổng số phân tử hòa tan trong dung dịch. Chất điện li của chất điện ly yếu thường dao động trong khoảng 0 < α < 1.

Các phương trình điện phân các chất yếu thường dùng mũi tên hai chiều để biểu diễn.
Ví dụ: Mg(OH)2 ⇌ Mg2+ + 2OH-
Điện phân chất điện li yếu là quá trình thuận nghịch. Để thiết lập cân bằng điện giải, tốc độ phân ly thành các ion và tốc độ kết hợp các ion thành phân tử phải bằng nhau.
Dạng mạnh
Chất điện ly mạnh là chất mà khi cho vào dung dịch nước, tất cả các phân tử của nó sẽ hòa tan và phân ly thành các ion tự do. Các chất mạnh bao gồm axit mạnh (như: HCl, H2SO4,…), bazơ mạnh (NaOH, Ba(OH)2,…) và hầu hết các muối.

Đối với Chất điện li mạnh, α = 1. Không giống như Chất điện li yếu, phương trình điện phân của nó sử dụng mũi tên một chiều để chỉ chiều của quá trình điện phân.
Ví dụ: H2SO4 ⭢ 2H++ SO42-
Bài tập lý thuyết về chất điện li

Bài tập 1: Câu trả lời nào sau đây đúng?
Dung dịch điện phân dẫn điện vì:
- Sự chuyển động của các electron.
- Sự chuyển động của cation
- Sự chuyển động của các phân tử hòa tan.
- Sự chuyển động của cation và anion.
Trả lời: D. Sự chuyển động của hai cation và anion.
Bởi vì khi hòa tan vào dung dịch (trong nước), các phân tử Chất điện li sẽ phân tách thành cation và anion.
Bài 2: Chất nào sau đây không dẫn điện?
- KCl rắn, khan.
- Làm tan chảy CaCl2.
- NaOH nóng chảy.
- HBr tan trong nước.
Trả lời: A. KCl rắn, khan.
Vì KCl rắn, khan ở dạng mạng tinh thể ion nên rất khó phá vỡ cấu trúc. Do đó, nó sẽ không thể tách các ion dương và ion âm (chuyển động tự do) và do đó sẽ không có khả năng dẫn điện.
Hi vọng bài viết này giúp nhiều bạn có cái nhìn tổng quát hơn về chất điện giải. Nếu bạn có thắc mắc hoặc cần câu trả lời, vui lòng để lại bên dưới phần bình luận.




